2021

Lista Benjamina 1/2, David WC MacMillan 1/2
Nagroda Nobla w dziedzinie chemii 2021 została przyznana wspólnie Benjaminowi Listowi i Davidowi WC MacMillanowi „za rozwój asymetrycznej organokatalizy”.
Pomysłowe narzędzie do budowania cząsteczekBudowanie cząsteczek to trudna sztuka. Benjamin List i David MacMillan otrzymują Nagrodę Nobla w dziedzinie chemii 2021 za opracowanie nowego, precyzyjnego narzędzia do budowy molekularnej: organokatalizy. Miało to ogromny wpływ na badania farmaceutyczne i uczyniło chemię bardziej ekologiczną.
Wiele obszarów badawczych i branż jest zależnych od zdolności chemików do konstruowania cząsteczek, które mogą tworzyć elastyczne i trwałe materiały, magazynować energię w bateriach lub hamować postęp chorób. Praca ta wymaga katalizatorów, czyli substancji, które kontrolują i przyspieszają reakcje chemiczne, nie stając się częścią produktu końcowego. Na przykład katalizatory w samochodach przekształcają toksyczne substancje zawarte w spalinach w nieszkodliwe cząsteczki. Nasze ciała zawierają również tysiące katalizatorów w postaci enzymów, które wykuwają cząsteczki niezbędne do życia.Katalizatory są zatem podstawowymi narzędziami dla chemików, ale naukowcy od dawna uważali, że zasadniczo dostępne są tylko dwa rodzaje katalizatorów: metale i enzymy.
Benjamin List i David MacMillan otrzymują Nagrodę Nobla w dziedzinie chemii 2021, ponieważ w 2000 roku, niezależnie od siebie, opracowali trzeci rodzaj katalizy. Nazywa się to asymetryczną organokatalizą i opiera się na małych cząsteczkach organicznych.„Ta koncepcja katalizy jest równie prosta, co genialna, a faktem jest, że wiele osób zastanawiało się, dlaczego nie pomyśleliśmy o tym wcześniej”, mówi Johan Åqvist, przewodniczący Komitetu Nobla ds. Chemii.
Katalizatory organiczne mają stabilny szkielet atomów węgla, do którego mogą przyłączać się bardziej aktywne grupy chemiczne. Często zawierają one pospolite pierwiastki, takie jak tlen, azot, siarka czy fosfor. Oznacza to, że katalizatory te są zarówno przyjazne dla środowiska, jak i tanie w produkcji.
Gwałtowny wzrost wykorzystania katalizatorów organicznych wynika przede wszystkim z ich zdolności do napędzania katalizy asymetrycznej. Kiedy budowane są cząsteczki, często zdarzają się sytuacje, w których mogą powstać dwie różne cząsteczki, które – podobnie jak nasze ręce – są swoim lustrzanym odbiciem. Chemicy często będą potrzebować tylko jednego z nich, szczególnie przy produkcji farmaceutyków.Organokataliza rozwija się w zdumiewającym tempie od 2000 roku.
Benjamin List i David MacMillan pozostają liderami w tej dziedzinie i wykazali, że katalizatory organiczne mogą być wykorzystywane do prowadzenia wielu reakcji chemicznych. Wykorzystując te reakcje, naukowcy mogą teraz wydajniej konstruować wszystko, od nowych farmaceutyków po cząsteczki, które mogą wychwytywać światło w ogniwach słonecznych. W ten sposób organokatalizatory przynoszą ludzkości największe korzyści.
2019

John B. Goodenough 1/3, M. Stanley Whittingham 1/3, Akira Yoshino 1/3
Nagroda Nobla w dziedzinie chemii 2019 nagradza rozwój akumulatora litowo-jonowego. Ta lekka, ładowalna i wydajna bateria jest teraz używana we wszystkim, od telefonów komórkowych po laptopy i pojazdy elektryczne. Może również magazynować znaczne ilości energii z energii słonecznej i wiatrowej, umożliwiając powstanie społeczeństwa wolnego od paliw kopalnych.Baterie litowo-jonowe są używane na całym świecie do zasilania przenośnej elektroniki, której używamy do komunikacji, pracy, nauki, słuchania muzyki i poszukiwania wiedzy. Baterie litowe umożliwiły również rozwój samochodów elektrycznych dalekiego zasięgu oraz magazynowanie energii ze źródeł odnawialnych, takich jak energia słoneczna i wiatrowa.Podwaliny pod baterię litowo-jonową położono podczas kryzysu naftowego w latach 70. XX wieku. Stanley Whittingham pracował nad opracowaniem metod, które mogłyby prowadzić do technologii energetycznych bez paliw kopalnych. Zaczął badać nadprzewodniki i odkrył niezwykle bogaty w energię materiał, z którego stworzył innowacyjną katodę w baterii litowej. Został on wykonany z dwusiarczku tytanu, który na poziomie molekularnym ma przestrzenie, które mogą pomieścić – interkalować – jony litu.Anoda baterii została częściowo wykonana z metalicznego litu, który ma silny napęd do uwalniania elektronów. Zaowocowało to baterią, która dosłownie miała ogromny potencjał, nieco ponad dwa wolty. Jednak metaliczny lit jest reaktywny, a akumulator był zbyt wybuchowy, aby mógł być użyteczny.
John Goodenough przewidział, że katoda miałaby jeszcze większy potencjał, gdyby była wykonana z tlenku metalu zamiast siarczku metalu. Po systematycznych poszukiwaniach w 1980 roku wykazał, że tlenek kobaltu z interkalowanymi jonami litu może wytwarzać nawet cztery wolty. Był to ważny przełom i doprowadziłby do powstania znacznie potężniejszych akumulatorów.Bazując na katodzie Goodenough, Akira Yoshino stworzył pierwszy komercyjnie opłacalny akumulator litowo-jonowy w 1985 roku. Zamiast używać reaktywnego litu w anodzie, zastosował koks naftowy, materiał węglowy, który, podobnie jak tlenek kobaltu katody, może interkalować jony litu.
W rezultacie powstał lekki, wytrzymały akumulator, który można było ładować setki razy, zanim jego wydajność się pogorszyła. Zaletą akumulatorów litowo-jonowych jest to, że nie są one oparte na reakcjach chemicznych, które rozbijają elektrody, ale na jonach litu przepływających tam i z powrotem między anodą a katodą.Baterie litowo-jonowe zrewolucjonizowały nasze życie, odkąd po raz pierwszy weszły na rynek w 1991 roku. Położyły podwaliny pod bezprzewodowe, wolne od paliw kopalnych społeczeństwo i przynoszą największe korzyści ludzkości.
2017

Jacques Dubochet 1/3, Joachim Frank 1/3, Richard Henderson 1/3
Jacques Dubochet, Joachim Frank i Richard Henderson „za opracowanie mikroskopii krioelektronowej do wysokorozdzielczego oznaczania struktury biocząsteczek w roztworze”.
Obraz jest kluczem do zrozumienia. Przełomy naukowe często opierają się na udanej wizualizacji obiektów niewidocznych dla ludzkiego oka. Jednak mapy biochemiczne od dawna są wypełnione pustymi przestrzeniami, ponieważ dostępna technologia ma trudności z generowaniem obrazów dużej części maszynerii molekularnej życia. Wszystko to zmienia mikroskopia krioelektronowa. Naukowcy mogą teraz zamrażać biomolekuły w trakcie ruchu i wizualizować procesy, których nigdy wcześniej nie widzieli, co ma decydujące znaczenie zarówno dla podstawowego zrozumienia chemii życia, jak i rozwoju farmaceutyków.
Od dawna uważano, że mikroskopy elektronowe nadają się tylko do obrazowania martwej materii, ponieważ potężna wiązka elektronów niszczy materiał biologiczny. Ale w 1990 roku Richardowi Hendersonowi udało się użyć mikroskopu elektronowego do wygenerowania trójwymiarowego obrazu białka w rozdzielczości atomowej. Ten przełom dowiódł potencjału technologii.
Joachim Frank sprawił, że technologia ta znalazła powszechne zastosowanie. W latach 1975-1986 opracował metodę przetwarzania obrazu, w której rozmyte, dwuwymiarowe obrazy mikroskopu elektronowego są analizowane i łączone w celu odkrycia ostrej trójwymiarowej struktury.
Jacques Dubochet dodał wodę do mikroskopii elektronowej. Ciekła woda odparowuje w próżni mikroskopu elektronowego, co powoduje zapadanie się biomolekuł. Na początku lat 80. Dubochetowi udało się zeszkleć wodę – schłodził ją tak szybko, że zestaliła się w postaci płynnej wokół próbki biologicznej, pozwalając biocząsteczkom zachować swój naturalny kształt nawet w próżni.Dzięki tym odkryciom zoptymalizowano każdą nakrętkę i śrubę mikroskopu elektronowego. Pożądaną rozdzielczość atomową osiągnięto w 2013 r., a naukowcy mogą teraz rutynowo tworzyć trójwymiarowe struktury biomolekuł. W ciągu ostatnich kilku lat literatura naukowa została wypełniona obrazami wszystkiego, od białek powodujących oporność na antybiotyki po powierzchnię wirusa Zika. Biochemia stoi teraz w obliczu gwałtownego rozwoju i jest przygotowana na ekscytującą przyszłość.
2015

Tomasz Lindahl 1/3, Paul Modrich 1/3, Aziz Sancar 1/3
Nagroda Nobla w dziedzinie chemii 2015 otrzymali łącznie Szwed - Tomas Lindahl, Amerykanie - Paul Modrich i Aziz Sancar "za badania mechanistyczne nad naprawą DNA".
Chodzi o mechanizmy naprawiające uszkodzenia w DNA. Owe uszkodzenia pojawiają się cały czas pod wpływem czynników takich jak promieniowanie czy wolne rodniki (bardzo reaktywne związki chemiczne, powstające w komórkach).
Gdyby błędy w DNA nie były naprawiane, komórki szybko obumierałyby lub zmieniałyby się w tkanki nowotworowe. Mechanizmy naprawiające nasz genom są też niezbędne w czasie podziałów komórkowych.
2012

Robert J. Lefkowitz 1/2, Brian K. Kobilka 1/2
Dwaj Amerykanie Robert J. Lefkowitz i Brian K. Kobilka zostali laureatami Nagrody Nobla 2012 w dziedzinie chemii za badania nad inteligentnymi receptorami na powierzchni komórek. Jak podaje anglojęzyczna Wikipedia, Kobilka wywodzi się z rodziny polskich imigrantów. Z kolei Robert J. Lefkowitz - według portalu poświęconego naukom przyrodniczym phys.org - jest wnukiem polskich Żydów, którzy wyemigrowali do USA.
W krótkim uzasadnieniu swojej decyzji Komitet Noblowski podał, że przyznano ją za „badania nad receptorami związanymi z białkiem G”. Jest to ważna grupa receptorów, dzięki którym komórki wyczuwają zmiany środowiska i mogą się do niego zaadaptować. Około połowa znanych obecnie leków działa za pośrednictwem tych związków.
Nagrodzeni Noblem Amerykanie Robert J. Lefkowitz (69 lat) i Brian K. Kobilka (57 lat)wspólnie prowadzili badania nad tymi związkami od lat 80. XX wieku.
Źródło: wp.pl
2009

Wenkatraman Ramakriszan 1/3, Thomas A. Steitz 1/3, Ada E. Yonath 1/3
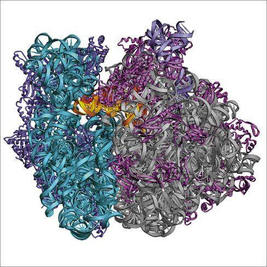
Venkatraman Ramakrishnan urodzony w 1952 r. w Chidambaram, Tamil Nadu, Indie, Thomas A. Steitz urodzony w 1940 r.z USA i Ada E. Yonath z Izraela urodzona w 1939 r.
Naukowcy zostali nagrodzeni za badania nad strukturą i funkcjami rybosomów.
Tegoroczni nobliści wyjaśnili, jak wygląda rybosom i jak funkcjonuje na poziomie atomów. Rybosomy są strukturami kluczowymi dla życia, przekładają bowiem informację genetyczną zawartą w DNA na białka tworzące komórki żywych organizmów.
Jak napisali członkowie Komitetu Noblowskiego w uzasadnieniu decyzji, Nagroda Nobla z chemii za 2009 rok jest docenieniem badań nad procesami kluczowymi dla życia.
Tegoroczni nobliści wyjaśnili, jak wygląda rybosom i jak funkcjonuje na poziomie atomów. Rybosomy są strukturami kluczowymi dla życia, przekładają bowiem informację genetyczną zawartą w DNA na białka tworzące komórki żywych organizmów.
Nie tylko Engels uważał życie za formę istnienia białka - głównie z białek składają się wszelkie żywe komórki, białka są materiałem budulcowym kości i mięśni, elastyczne białka tworzą ścięgna, twarda keratyna - włosy, paznokcie, a przezroczysta krystalina - soczewki naszych oczu. Białkami są przeciwciała, które chronią organizm przed zarazkami, hormony takie jak insulina, enzymy trawienne, przenosząca tlen hemoglobina. W żywym organizmie potrzebne są dziesiątki tysięcy pełniących różne funkcje białek.
Białka są długimi łańcuchami połączonych cząsteczek zwanych aminokwasami. Podobnie jak z ograniczonej liczby znaków alfabetu można utworzyć miliony różnych słów w setkach języków i praktycznie nieskończona liczbę dzieł literackich, także miliony białek składają się z zaledwie dwudziestu rodzajów aminokwasów. Najdłuższym ze znanych białek jest zawarta w mięśniach tytyna(zwana też konektyną) - to łańcuch 26 926 aminokwasów. Dokładna nazwa chemiczna tego białka w języku angielskim jest nie do wymówienia - liczy ponad 189 tysięcy znaków.
O ile do stworzenia dowolnego białka wystarczy odpowiednia liczba odpowiednio ułożonych aminokwasów, których jest 20, to informacja o tym zapisana jest w kodzie DNA złożonym z zaledwie czterech liter, zwanych nukleotydami. Dlatego potrzebny jest mechanizm, który przetłumaczy zawartą w DNA teorię na aminokwasowy język praktyki.
Właśnie tym zajmują się rybosomy, będące wydajnymi wytwórniami białek. Dzięki Venkatramanowi Ramakrishanowi, Thomasowi A. Steitzowi i Adzie E. Yonath dokładnie wiemy, jak wyglądają i jak są zbudowane. Za pomocą techniki krystalografii rentgenowskiej udało się ustalić pozycję każdego z setek tysięcy atomów tworzących rybosom. Aby uzyskać rybosomy w niezbędnej dla potrzeb krystalografii postaci krystalicznej, Ada Yonath wybrała szczególnie stabilne rybosomy z żyjącej w gorących źródłach bakterii Geobacillus stearothermophilus oraz zamieszkującego Morze Martwe mikroorganizmu Haloarcula marismortui.
W procesie zwanym translacją, rybosomy wytwarzają białka na podstawie informacji zawartych w nici DNA - jednak nie korzystają z tej informacji bezpośrednio. Gdy potrzebne jest jakieś białko, "plan budowy" jest przenoszony z jądra komórki przez informacyjny RNA (mRNA). RNA jest substancją podobną do DNA, choć różni się od niego jedną "literą" - nukleotydem. Gdy mRNA połączy się z rybosomem, zaczyna się synteza. Większa jednostka rybosomu zajmuje się łączeniem aminokwasów zgodnie z planem, mniejsza - "kontrolą jakości". Dzięki temu błędy zdarzają się bardzo rzadko - raz na 100 000 aminokwasów.
Wiele obecnych antybiotyków działa na rybosomy bakterii - blokując je, uniemożliwiają mikroorganizmom normalne funkcjonowanie. Tegoroczni laureaci opracowali trójwymiarowe modele rybosomów, dzięki którym opracowywanie nowych antybiotyków jest łatwiejsze i szybsze. Oczywiście antybiotyki nie przeszkadzają w działaniu rybosomom człowieka.
Nagroda w wysokości 10 mln koron (ok.1,4 USD) zostanie rodzielona równo między laureatów po 1/3.
Venkatraman Ramakrishnan jest pracownikiem MRC Laboratory of Molecular Biology w Cambridge; Thomas A. Steitz, pracuje w Yale University w New Haven oraz w Instytucie Medycznym Howarda Hughesa w Chevy Chase, w stanie Maryland, a Ada E. Yonath, , prace badawcze prowadzi w Instytucie Naukowym Weizmanna w Rehovot.
Nobel z chemii jest przyznawany od 1901 roku. W 1911 roku otrzymała go Maria Skłodowska-Curie wspólnie z mężem Piotrem Curie, za wydzielenie czystego radu. Polka była pierwszą kobietą, którą dostała Nobla z chemii.
Źródło: Wirtualna Polska, Rzeczpospolita,Money.pl oraz Nobelprize.org
2011

Dan Shechtman
Nagrodę Nobla z chemii otrzymał 70-letni Izraelczyk Daniel Shechtman.
Komitet Noblowski uhonorował go za odkrycie kwazikryształów - struktur, których istnienie w przyrodzie uznawano wcześniej za niemożliwe. Shechtman otrzyma nagrodę w wysokości 10 mln koron szwedzkich, czyli ok. 1,5 mln dolarów. 70-letni naukowiec pracuje w Izraelskim Instytucie Technologicznym (Technion - Israel Institute of Technology) w Hajfie.
Laureat jako pierwszy zaobserwował kryształy, w których występują regularne koncentryczne kręgi, składające się z dziesięciu elementów. To zjawisko przeczyło przyjętym prawom krystalografii, mówiącym, że kryształy mogą powstawać z takich układów, ale składających się maksymalnie z sześciu elementów. Np. w krysztale składającym się ze struktur czteroelementowych każdy atom jest otoczony zawsze czterema innymi atomami, nawet jeśli ogląda się całość pod różnymi kątami. Niemożliwe jest uzyskanie tak regularnej struktury, złożonej z układów zawierających siedem lub więcej elementów. Noblista zaobserwował pod mikroskopem elektronowym nieznaną wcześniej strukturę skrystalizowanego metalu, będącego stopem aluminium i manganu. Stało się to w kwietniu 1982 r. „Niemal wszystkie ciała stałe, od lodu do złota, składają się z uporządkowanych kryształów. Niemniej obraz dyfrakcji z dziesięcioma jasnymi kropkami, ułożonymi w okręgi był czymś, czego (Shechtman - PAP) nigdy wcześniej nie widział, mimo swojego rozległego doświadczenia w wykorzystaniu mikroskopów elektronowych. Ponadto tego typu kryształów nie uwzględniały międzynarodowe tablice krystalograficzne (International Tables for Crystallography). (...) W owym czasie środowisko naukowe uznawało po prostu, że wzór z dziesięcioma kropkami położonymi na okręgach nie może istnieć” – napisano w komunikacie prasowym Komitetu Noblowskiego. Odkrycie Shechtmana początkowo nie znalazło akceptacji w środowisku krystalografów. „Niektórzy koledzy posunęli się nawet do wyśmiewania go” – przypomniał Komitet Noblowski. Shechtmanowi zarzucano m.in. błąd metodyczny, twierdząc, że zaobserwowana przez niego struktura nie stanowi jednolitego ciała stałego, ale jest obrazem powstałym z nałożenia się na siebie dwóch różnych kryształów. Później jednak inni naukowcy powtórzyli eksperymenty Shechtmana i okazało się, że podobne struktury rzeczywiście istnieją. Przez długi czas nie udawało się jednak wyjaśnić, jak to możliwe. Pomogła matematyka i arabska sztuka.
Źródł: wnp.pl
1935
Nagroda Nobla w dziedzinie chemii 1935 została przyznana wspólnie Frédéricowi Joliot i Irène Joliot-Curie „w uznaniu ich syntezy nowych pierwiastków promieniotwórczych”.
1911

Maria Skłodowska-Curie
Nagrodę Nobla w dziedzinie chemii 1911 przyznano Marii Curie z domu Skłodowskiej „w uznaniu jej zasług dla rozwoju chemii przez odkrycie pierwiastków radu i polonu, izolację radu oraz badanie natury i związków tego pierwiastka”.
2020

Emmanuelle Charpentier 1/2, Jennifer A. Doudna 1/2
Nagroda Nobla w dziedzinie chemii 2020 została przyznana wspólnie Emmanuelle Charpentier i Jennifer A. Doudnie „za opracowanie metody edycji genomu”.
Nożyczki genetyczne: narzędzie do przepisywania kodu życiaEmmanuelle Charpentier i Jennifer A. Doudna odkryli jedno z najostrzejszych narzędzi technologii genetycznej: nożyczki genetyczne CRISPR/Cas9. Dzięki nim naukowcy mogą zmieniać DNA zwierząt, roślin i mikroorganizmów z niezwykle wysoką precyzją. Technologia ta wywarła rewolucyjny wpływ na nauki przyrodnicze, przyczynia się do tworzenia nowych terapii przeciwnowotworowych i może spełnić marzenie o leczeniu chorób dziedzicznych.Naukowcy muszą zmodyfikować geny w komórkach, jeśli mają poznać wewnętrzne mechanizmy życia. Kiedyś była to praca czasochłonna, trudna, a czasem niemożliwa. Używając nożyczek genetycznych CRISPR/Cas9, można teraz zmienić kod życia w ciągu kilku tygodni.
„W tym narzędziu genetycznym jest ogromna moc, która dotyczy nas wszystkich. To nie tylko zrewolucjonizowało naukę podstawową, ale także zaowocowało innowacyjnymi uprawami i doprowadzi do przełomowych nowych metod leczenia”, mówi Claes Gustafsson, przewodniczący Komitetu Nobla ds. Chemii.Jak to często bywa w nauce, odkrycie tych genetycznych nożyczek było nieoczekiwane. Podczas badań prowadzonych przez Emmanuelle Charpentier nad Streptococcus pyogenes, jedną z bakterii najbardziej szkodliwych dla ludzkości, odkryła nieznaną wcześniej cząsteczkę, tracrRNA.
Jej praca wykazała, że tracrRNA jest częścią pradawnego układu odpornościowego bakterii, CRISPR/Cas, który rozbraja wirusy poprzez przecinanie ich DNA.Charpentier opublikowała swoje odkrycie w 2011 roku. W tym samym roku zainicjowała współpracę z Jennifer Doudną, doświadczoną biochemiczką o ogromnej wiedzy na temat RNA. Wspólnie udało im się odtworzyć genetyczne nożyczki bakterii w probówce i uprościć komponenty molekularne nożyczek, aby były łatwiejsze w użyciu.W epokowym eksperymencie przeprogramowali nożyce genetyczne. W swojej naturalnej formie nożyczki rozpoznają DNA wirusów, ale Charpentier i Doudna udowodnili, że można nimi sterować, aby przeciąć dowolną cząsteczkę DNA w określonym miejscu. Tam, gdzie DNA jest cięte, łatwo jest przepisać kod życia.Odkąd Charpentier i Doudna odkryli genetyczne nożyczki CRISPR/Cas9 w 2012 roku, ich użycie eksplodowało. Narzędzie to przyczyniło się do wielu ważnych odkryć w badaniach podstawowych, a badaczom roślin udało się opracować uprawy odporne na pleśń, szkodniki i suszę. W medycynie trwają badania kliniczne nad nowymi terapiami przeciwnowotworowymi, a marzenie o możliwości leczenia chorób dziedzicznych ma się spełnić. Te genetyczne nożyczki przeniosły nauki przyrodnicze w nową epokę i pod wieloma względami przynoszą ludzkości największe korzyści.
2018

Frances H. Arnold 1/2, George P. Smith 1/4, Sir Gregory P. Winter 1/4
Nagroda Nobla w dziedzinie chemii 2018 została podzielona, jedną połowę przyznano Frances H. Arnold „za ukierunkowaną ewolucję enzymów”, drugą połowę wspólnie George P. Smith i Sir Gregory P. Winter „za prezentację fagową peptydów i przeciwciał”.
Siła ewolucji objawia się poprzez różnorodność życia. Laureaci Nagrody Nobla w dziedzinie chemii 2018 przejęli kontrolę nad ewolucją i wykorzystali ją do celów, które przynoszą największe korzyści ludzkości. Enzymy wytwarzane w drodze ukierunkowanej ewolucji są wykorzystywane do produkcji wszystkiego, od biopaliw po farmaceutyki. Przeciwciała wyewoluowane przy użyciu metody zwanej prezentacją fagową mogą zwalczać choroby autoimmunologiczne, aw niektórych przypadkach leczyć raka z przerzutami.
Odkąd pierwsze nasiona życia pojawiły się około 3,7 miliarda lat temu, prawie każda szczelina na Ziemi wypełniła się różnymi organizmami. Życie rozprzestrzeniło się na gorące źródła, głębokie oceany i suche pustynie, a wszystko to dlatego, że ewolucja rozwiązała szereg problemów chemicznych. Narzędzia chemiczne życia – białka – zostały zoptymalizowane, zmienione i odnowione, tworząc niesamowitą różnorodność.Tegoroczni laureaci Nagrody Nobla w dziedzinie chemii zainspirowali się potęgą ewolucji i wykorzystali te same zasady – zmiany genetyczne i selekcję – do opracowania białek, które rozwiązują chemiczne problemy ludzkości.Połowa tegorocznej Nagrody Nobla w dziedzinie chemii przypada Frances H. Arnold .
W 1993 roku przeprowadziła pierwszą ukierunkowaną ewolucję enzymów, czyli białek katalizujących reakcje chemiczne. Od tego czasu udoskonaliła metody, które są obecnie rutynowo stosowane do opracowywania nowych katalizatorów. Zastosowania enzymów Frances Arnold obejmują bardziej przyjazną dla środowiska produkcję substancji chemicznych, takich jak farmaceutyki, oraz produkcję paliw odnawialnych dla bardziej ekologicznego sektora transportu.Drugą połowę tegorocznej Nagrody Nobla w dziedzinie chemii dzielą George P. Smith i Sir Gregory P. Winter.
W 1985 roku George Smith opracował elegancką metodę zwaną prezentacją fagową, w której bakteriofag – wirus infekujący bakterie – może być wykorzystany do ewolucji nowych białek. Gregory Winter wykorzystał prezentację fagową do ukierunkowanej ewolucji przeciwciał w celu wytworzenia nowych farmaceutyków. Pierwszy oparty na tej metodzie, adalimumab, został zarejestrowany w 2002 roku i jest stosowany w reumatoidalnym zapaleniu stawów, łuszczycy i nieswoistych zapaleniach jelit. Od tego czasu prezentacja fagowa wytworzyła przeciwciała, które mogą neutralizować toksyny, przeciwdziałać chorobom autoimmunologicznym i leczyć raka z przerzutami.Znajdujemy się na początku rewolucji kierowanej ewolucji, która na wiele różnych sposobów przynosi i przyniesie ludzkości największe korzyści.
2016

Jean-Pierre Sauvage 1/3, Sir J. Fraser Stoddart 1/3, Bernard L. Feringa 1/3
Nagrodę Nobla w dziedzinie chemii w 5 października 2016 r. otrzymali: Jean-Pierre Sauvage, Sir J. Fraser Stoddart oraz Bernard L. Feringa za „zaprojektowanie i syntezę maszyn molekularnych”, na przykład sztucznych mięśni czy miniaturowych silniczków, niezbędnych do rozwoju nanotechnologii.
Maszyny molekularne, nad którymi pracowali naukowcy, „będą najprawdopodobniej wykorzystywane w rozwoju nowych materiałów, czujników i systemów przechowywania energii” – uzasadnia Królewska Szwedzka Akademia Nauk.
Uhonorowani w środę Nagrodą Nobla w dziedzinie chemii Jean-Pierre Sauvage, Fraser Stoddart i Bernard Feringa zajmują się miniaturowymi maszynami, działającymi w skali molekularnej.
Sauvage w 1983 r. połączył dwie cząsteczki w kształcie pierścienia w łańcuch. Stoddart w 1991 roku, nawlekł taki pierścień na molekularną oś. Feringa opracował molekularny „silniczek” w 1999 r.
Sauvage (71 lat) jest emerytowanym profesorem University of Strasbourg i dyrektorem ds badań we francuskim CNRS. Stoddart (74 lat) jest profesorem chemii na Northwestern University w Evanston (Illinois, USA). Feringa (65 lat) jest profesorem chemii organicznej na holenderskim uniwersytecie w Groningen.
Jeden z tegorocznych Noblistów, Bernard L. Feringa został w 2013 roku podczas 56. Zjazdu Naukowego PTChem i SITPChem w Siedlcach wyróżniony Medalem im. Marii Skłodowskiej-Curie. Medal ten przyznaje się chemikowi pracującemu za granicą za wybitne osiągnięcia naukowe o światowym znaczeniu w chemii. Na zdjęciu prof. Bogusław Buszewski wręcza medal prof. Bernardowi L. Feringa.
2014

Eric Betzig 1/3, Stefan W. Piekło 1/3, Williama E. Moernera 1/3
Nagrodę otrzymali Eric Betzig, William E. Moerner oraz Stefan W. Hell za „pracę nad mikroskopem fluorescencyjnym wysokiej rozdzielczości”.
Nagroda dla naukowców za ich pracę nad mikroskopem fluorescencyjnym wysokiej rozdzielczości.
Eric Betzig urodził się 13 stycznia 1960 roku w Ann Arbor. Jest amerykańskim fizykiem. Studiował na California Institute of Technology (ukończył fizykę w 1983 roku). Doktorat z fizyki stosowanej obronił w 1988 roku na Cornell University. Pracując niezależnie od Williama E. Moernera opracował mikroskopię jednomolekułową.
William E. Moerner urodził się 24 czerwca 1953 roku. Jest amerykańskim fizykiem chemicznym. Studiował na Washington University w St. Louis. Jest profesorem na Stanford University. Wraz z Erickiem Betzigiem (naukowcy pracowali niezależnie) stworzył podstawy mikroskopii jednomolekułowej.Stefan W. Hell urodził się 23 grudnia 1962 roku w Rumunii. Z wykształcenia jest fizykiem. Studiował na University of Heidelberg. Jest jednym z dyrektorów Max Planck Institute for Biophysical Chemistry w Göttingen. W 2000 roku opracował pierwszy mikroskop STED (mikroskop fluorescencyjny).
2013

Martin Karplus 1/3, Michael Levitt 1/3, Arieh Warshel 1/3
Nagroda Nobla w dziedzinie chemii 2013 otrzymał wspólnie z Martinem Karplus, Michael Levitt i Arieh Warshel „rozwój wielozakresowy modeli złożonych układów chemicznych” (komputerowe modele układów chemicznych).
Trzej uczeni podzielą się nagrodą wynoszącą 8 mln koron szwedzkich (ok. 4 mln złotych). Laureaci „stworzyli podstawy pod potężne programy, których używamy, aby zrozumieć i przewidywać procesy chemiczne” – napisał Komitet w uzasadnieniu. Reakcje chemiczne zachodzą tak szybko – w ułamku milisekundy – i w tak małej skali, że nie da się bezpośrednio obserwować każdego ich etapu. Dlatego chemicy używają komputerów.
„Modelowanie matematyczne procesów chemicznych można porównać do odsłaniania wnętrza zegarka i obserwowania jak on działa” – uważa Warshel. Aby modelować reakcje chemiczne, komputerowe modele muszą łączyć zasady klasycznej fizyki z egzotycznymi regułami fizyki kwantowej. W przypadku fizyki klasycznej obliczenia są łatwe i można badać bardzo duże cząsteczki, ale tylko w stanie spoczynku. Pod wpływem przepływu energii kształt cząsteczki ulega zmianie. Dlatego do opisu potrzebna jest mechanika kwantowa. Jednak w jej przypadku obliczenia muszą uwzględniać zachowanie każdego jądra atomowego i każdego elektronu – są skomplikowane i dlatego możliwe tylko w przypadku małych cząsteczek.
Tegorocznym noblistom udało się skutecznie połączyć oba rodzaje obliczeń. Gdy na przykład lek działa na białkowy receptor, obliczenia kwantowe dotyczą atomów bezpośrednio zaangażowanych w reakcję, podczas gdy zachowanie liczącej tysiące atomów reszty cząsteczki opisuje fizyka klasyczna.
Modele reakcji mają uniwersalne znaczenie. Oprócz tworzenia nowych leków, mogą znaleźć zastosowanie w przemyśle, na przykład przy tworzeniu nowych katalizatorów czy sprawniejszych baterii słonecznych. Komputery stały się dla chemików narzędziem równie ważnym, co probówki – jednak nie zastępują ich całkowicie. Wyniki doświadczeń modelowane są komputerowo, a komputerowe symulacje – sprawdzane doświadczalnie.
Niespełnionym na razie marzeniem Levitta pozostaje symulowanie działania całego organizmu na poziomie molekularnym.
„To nagroda za wprowadzenie metod symulacji komputerowych do świata biologii. Struktura białek decyduje o ich funkcji. Jeżeli szukamy nowego, skutecznego leku – musimy znać strukturę białek, które uczestniczą w różnych procesach” – podkreślił prof. Robert Hołyst z Instytutu Chemii Fizycznej PAN.
„Tym werdyktem bardzo doceniono aplikacyjne znaczenie nauki, czyli przełożenie teorii na praktykę – powiedział prof. Jarosław Polański z Instytutu Chemii Uniwersytetu Śląskiego. Nobliści byli jednymi z pierwszych naukowców, którzy działali na styku informatyki, biologii i chemii”. Ich pomysły nie zawsze cieszyły się popularnością. Teraz jednak komputery stały się tak potężne, że jesteśmy bez nich niemal bezsilni" – ocenił rozmówca PAP.
„Badania noblistów umożliwiły wgląd w architekturę i dynamikę cząsteczek, a przede wszystkim w to, jak one działają podczas reakcji chemicznych” – powiedział PAP prof. Janusz Bujnicki, kierownik Laboratorium Bioinformatyki i Inżynierii Białka z Międzynarodowego Instytutu Biologii Molekularnej i Komórkowej w Warszawie oraz pracownik Wydziału Biologii Uniwersytetu im. Adama Mickiewicza w Poznaniu.
„To ukłon w stronę chemii teoretycznej" – ocenił w rozmowie z PAP prof. dr hab. Zdzisław Latajka, kierownik Zespołu teoretycznego modelowania procesów chemicznych na Wydziale Chemii Uniwersytetu Wrocławskiego.
Źródło: pap
2010

Richard F. Heck 1/3, Ei-ichi Negishi 1/3, Akira Suzuki 1/3
Królewska Akademia Nauk Szwecji ogłosiła kolejne nazwiska tegorocznych noblistów - tym razem z chemii. Nobla za stworzenie metod pozwalających na tworzenie skomplikowanych cząsteczek organicznych (zbudowanych m.in. z węgla), imitujących te, które występują w naturze, otrzymali Amerykanin i dwóch Japończyków: Richard F. Heck, Ei-ichi Negishi (75 l.) oraz Akira Suzuki (80 l.).
Zostali nagrodzeni za opracowanie metody polegającej na tworzeniu związków chemicznych na bazie węgla przy wykorzystaniu palladu, tak skomplikowanych jak te powstające w naturze. Metoda ta pozwoliła na tworzenie zaawansowanych leków i tworzyw sztucznych i podzespołów elektronicznych.
W uzasadnieniu szwedzkiej Królewskiej Akademii Nauk czytamy, że nobliści otrzymali nagrodę za wymyślenie „bardziej efektywnych sposobów łączenia atomów węgla w złożone cząsteczki, które mogą znaleźć zastosowanie w wielu sferach codziennego życia”.
2008

Osamu Shimomura 1/3, Martin Chalfie 1/3, Roger Y. Tsien 1/3

Nagrodą Nobla w dziedzinie chemii podzielą się trzej przedstawiciele USA - Osamu Shimomura, Martin Chalfie i Roger Y. Tsien. Prace laureatów dotyczą świecącego na zielono białka GFP, wyizolowanego po raz pierwszy od meduzy. Nagroda wynosi 10 mln koron szwedzkich (ok. 3,5 mln zł).
Żywy organizm tworzą dziesiątki tysięcy współdziałających ze sobą białek o najróżniejszych właściwościach - od twardej keratyny tworzącej paznokcie, rogi czy kopyta, do przezroczystej krystaliny soczewki oka, elastycznej elastyny, czy odpowiedzialnych za procesy życiowe enzymów. Jeśli jakieś białka źle spełniają swoje funkcje, dochodzi do choroby. Dlatego tak ważne jest poznanie właściwości i roli ich wszystkich. Jednak pod zwykłym mikroskopem większość białek jest do siebie podobna - widać białawą masę. Tym, co je różni, jest kolejność aminokwasów w łańcuchu białka, jego długość i sposób zwinięcia.
Tegoroczną Nagrodę Nobla w dziedzinie chemii przyznano za odkrycie nietypowego, świecącego białka GFP, wytwarzanego przez żyjącą u zachodnich wybrzeży Ameryki Północnej meduzę Aequorea victoria, czego dokonał w roku 1962 Osamu Shimomura oraz dalsze prace nad tym białkiem Martina Chalfie oraz Rogera Y.Tsiena.
Martin Chalfie wykazał, że świecące intensywnie na zielono pod wpływem ultrafioletu, złożone z 238 aminokwasów, białko GFP jest niezwykle wygodnym znacznikiem, a odpowiednia modyfikacja DNA pozwala wiązać je z innymi, dotychczas niewidocznymi białkami. Pierwszym zwierzęciem na jakim Chalfie wypróbował swój pomysł był mały przezroczysty nicień - Cenorhabditis elegans. Później pojawiły się świecące rybki, myszy, koty, psy, a nawet świnie.
Dzięki znakowaniu GFP można obserwować umiejscowienie, przemieszczanie i działanie znakowanych białek. GFP pozwoliło na przykład śledzić los komórek nerwowych uszkodzonych przez chorobę Alzheimera, wzrost chorobotwórczych bakterii czy powstawanie wytwarzających insulinę komórek beta w trzustce rozwijającego się zarodka. Można nawet śledzić procesy zachodzące wewnątrz żywej komórki.
Świecących białek używają obecnie tysiące badaczy na całym świecie
Świecących białek używają obecnie tysiące badaczy na całym świecie. Podczas jednego z najbardziej efektownych eksperymentów udało się oznaczyć różne komórki mózgu myszy wieloma różnymi kolorami - to zasługa Rogera Y. Tsiena, który wyjaśnił mechanizm fluorescencji GFP i otrzymał białka świecące barwami innymi niż zielona, w tym w kolorze czerwonym, śliwkowym, cytrynowym i pomarańczowym.
Oprócz badań naukowych, świecące białka zastosowano również przy wykrywaniu zanieczyszczeń wody metalami ciężkimi, takimi jak arsen czy kadm, oraz materiałów wybuchowych. Są także barwione tymi białkami świecące zabawki. Eduardo Kac, artysta urodzony w Brazylii stworzył nawet transgenicznego, świecącego na zielono królika Albę - jedno z najbardziej znanych dzieł „bio artu”.

 Kreator www - przetestuj za darmo
Kreator www - przetestuj za darmo